多中心生物标志物研究
该案例研究证明了我们的监督分析流程的高重现性,该流程基于对造血干细胞移植后 10 天的健康受试者和患者的外周血样本的分析,使用来自不同供应商和跨中心的不同仪器。
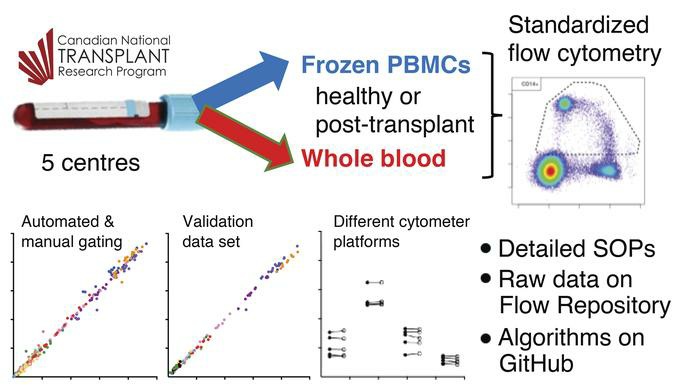
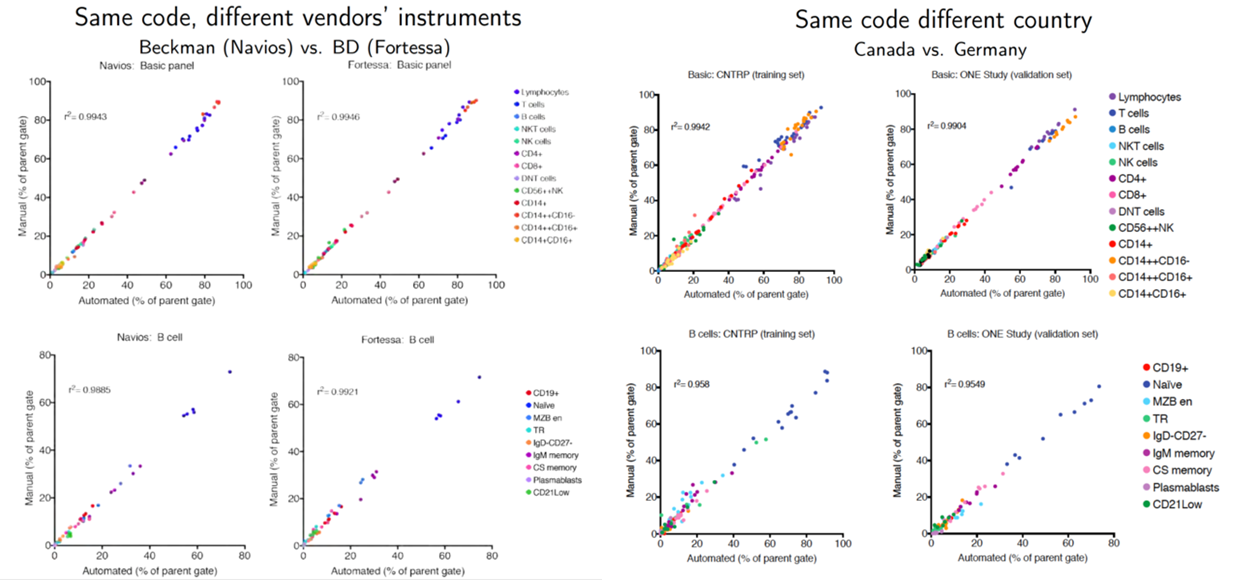
我们开发了一个基于 flowCore 和 flowDensity 的自动化分析工作流程。使用 DuraClone 的干试剂生成数据。预格式化面板抗体鸡尾酒技术(Beckman Coulter)。自动化管道的性能是通过其匹配专家手动分析器(即参考手册)获得的每个事件基础值的能力来评估的,目前被认为是“黄金标准”方法。此外,我们将参考手动值与另外 2 台遵循相同门控策略的手动分析仪获得的值进行了比较。自动分析产生的结果与参考手动分析中获得的结果高度相关。例如,将参考手册与 14 个基本面板细胞群的自动分析进行比较的 Spearman 等级相关系数 [ρ, rs] 均 > 0。8. 大多数 F1 分数中位数 > 0.9,总体 F1 平均值为 0.93。为了证明稳健性,我们从 ONE Study 中获得了一个独立的数据集,该数据集使用相同的抗体面板和荧光强度设置,并通过我们的自动化流程手动重新分析了这些数据。当对两个数据集的所有分析人群进行组合时,自动门控和手动门控之间的相关值均 > 0.9,这表明使用一组数据开发的自动门控管道可以很容易地用于准确分析独立数据,如果它们是使用相同的数据收集的标准化的方法。为了测试分析管道对备用仪器平台的稳健性,我们分析了在 Navios(Beckman Coulter,3 个激光器)或 Fortessa X20(BD Biosciences,4 个激光器)上采集的平行样本,并获得相关值> 0.99。一般来说,我们发现自动门控与参考手册的一致性略低于其他手动门控。与康拉德研究一样,一致性较低,特别是对于低丰度、定义不明确的人群(例如,浆母细胞)。不明确的界限,例如 CD14+ 和 CD14++ 之间(特别是在 CD16+ 人群中)以及 CD16– 和 CD16+ 之间的界限导致手动门控的可变性(手册 1 和手册 2 与参考手册,两者 rs = 0.83),以及如自动与参考手册(rs = 0.83)。
上一篇:PD-L1 的自动门控
下一篇:用于人体免疫分析的自动化管道

 售前咨询专员
售前咨询专员
